Notícias
Imagens: Divulgação
 As pessoas têm as mais diversas respostas para "O que é corrosão". Alguns dizem que é oxidação, outras dizem que é um ataque químico, enquanto alguns dizem que é um fenômeno elétrico, a eletrólise. Cada uma dessas respostas é parcialmente verdadeira. Excetuando alguns tipos não usuais de corrosão, como bacteriana ou por ataque químico direto, pode-se dizer que a corrosão, como normalmente encontrada numa tubulação metálica, é, basicamente, um processo eletroquímico por natureza.
As pessoas têm as mais diversas respostas para "O que é corrosão". Alguns dizem que é oxidação, outras dizem que é um ataque químico, enquanto alguns dizem que é um fenômeno elétrico, a eletrólise. Cada uma dessas respostas é parcialmente verdadeira. Excetuando alguns tipos não usuais de corrosão, como bacteriana ou por ataque químico direto, pode-se dizer que a corrosão, como normalmente encontrada numa tubulação metálica, é, basicamente, um processo eletroquímico por natureza.
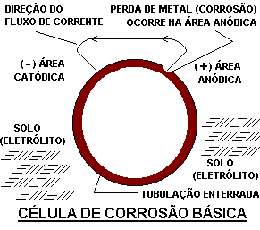
Uma tubulação é essencialmente um pedaço de metal envolvido por um eletrólito. Ao longo do tempo, os potenciais elétricos podem variar de um ponto da tubulação para outro, como resultado da existência de áreas anódicas e catódicas. Estas áreas de diferentes potenciais elétricos são a base para uma célula de corrosão.
Algumas condições específicas devem estar presentes antes que uma célula de corrosão passe a atuar:
 1. Existência de um ânodo e de um cátodo.
1. Existência de um ânodo e de um cátodo.
2. Existência de um potencial elétrico entre o ânodo e o cátodo. (Este potencial pode ter diversas origens em tubulações.)
3. Deve existir um caminho metálico conectando elétricamente o ânodo e o cátodo.
4. O ânodo e o cátodo devem estar imersos num eletrólito eletricamente condutivo. A mistura de solo comum ou água, circundando as tubulações, é o suficiente, normalmente, para preencher estas condições.
Na presença desta condições, uma célula de corrosão é criada, uma corrente elétrica fluirá, e o metal será consumido no ânodo. Se uma dessas quatro condições for removida, a corrosão é interrompida.
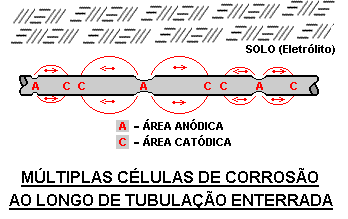
O ânodo e o cátodo de uma célula de corrosão podem estar afastados entre si por alguns centímetros ou metros, dependendo da origem da diferença de potencial entre os dois pontos. A taxa de corrosão é diretamente proporcional à taxa do fluxo de corrente. A taxa do fluxo de corrente é afetada por diversos fatores, entre eles, a resistividade do solo e a eficiência do revestimento da tubulação.
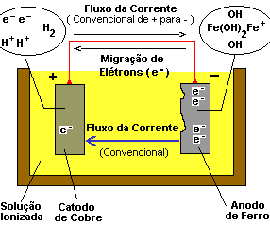
A pressão elétrica entre o ânodo e o cátodo resulta numa migração de elétrons do ânodo para o cátodo ao longo do caminho metálico. No ânodo, com a perda de elétrons, permanecem átomos de carga positiva de ferro que se combinam com íons do ambiente carregados negativamente (HO-), formando hidróxido ferroso, que, por sua vez, normalmente, reage a seguir para formar hidróxido férrico (Ferrugem).
 No cátodo, um acréscimo de elétrons chegaram do ânodo. Este acréscimo de íons carregados negativamente se combinam com íons de hidrogênio do ambiente, carregados positivamente, formando hidrogênio (H2). Este hidrogênio no cátodo é a base do filme de polarização.
No cátodo, um acréscimo de elétrons chegaram do ânodo. Este acréscimo de íons carregados negativamente se combinam com íons de hidrogênio do ambiente, carregados positivamente, formando hidrogênio (H2). Este hidrogênio no cátodo é a base do filme de polarização.
Para uso prático, o fluxo de corrente é definido em termos do conceito convencional, que é contrário ao conceito atual de fluxo de elétrons. A primeira imagem mostra a direção convencional, de + (mais positivo) para - (mais negativo) na parte metálica do circuito. O circuito é completado pelo eletrólito. Na segunda imagem, estão representações esquemáticas da corrosão, mostrando a direção da corrente na sua forma convencional.
Os seguintes pontos devem ser lembrados em termos de fluxo de corrente convencional:
1. O fluxo de corrente convencional, no circuito metálico, será no sentido do cátodo para o ânodo;
2. O fluxo de corrente convencional, no eletrólito, será no sentido do ânodo para o cátodo;
3. O metal é consumido onde a corrente deixa a estrutura para entrar no eletrólito que a envolve;
4. O metal que recebe corrente suficiente do eletrólito envolvente não é corroído.
Gostou? Então compartilhe:
